Введение
Перед тем, как приступить к рассмотрению основных положений зонной теории необходимо вспомнить некоторые положения из школьного курса физики. В частности, элементы молекулярно-кинетической и атомно-молекулярной теории.
Античные представления о строении вещества
История науки гласит, что около 2500 лет назад древнегреческие философы Левкипп и Демокрит, изображения которых показаны на рисунке 1, путём логических рассуждений предположили, что любое вещество состоит из мельчайших неделимых частиц.

Демокрит назвал эти частицы атомами (от латинского «атмос» -- не-делимый).
Развитие атомистической теории
Прошли сотни лет, прежде чем физика, химия и философия объединившись в лице великих учёных из разных стран, таких, как:
Михаил Васильевич Ломоносов сформулировал основные положения молекулярно-кинетической теории теплоты.
Джон Дальтон изложил атомистическую гипотезу в труде «Новая система химической философии».
Джозеф Джон Томсон открыл электрон в 1897г. и доказал его существование в 1898г.
и многих других, доказали общепринятое на сегодняшний день строение вещества (рисунок 2).
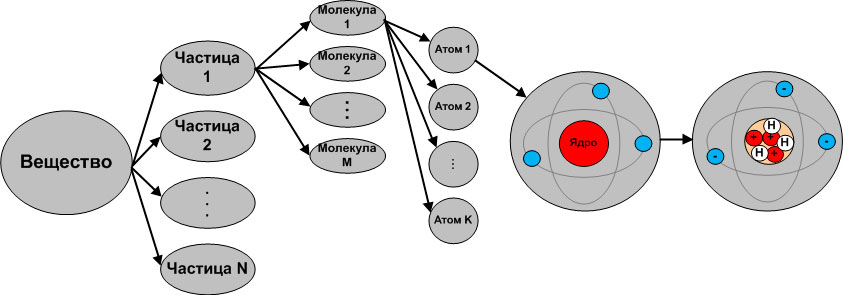
Современное представление о строении вещества
Итак, все тела состоят из частиц вещества. Вещество состоит из молекул или атомов. Молекулы представляют собой электрически нейтральные частицы, образованные из двух и более атомов. Атомы состоят из протонов и нейтронов, образующих ядро атома и электронов, вращающихся вокруг ядра атома.
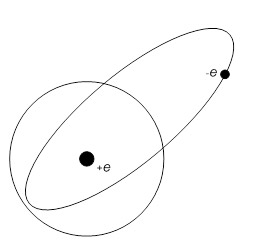
Схематически такое размещение электронов относительно ядра атома можно представать в виде модели Резерфорда-Бора-Зоммерфельда показанной на рисунке 3.
Развитие моделей атома
Эволюция представлений о строении атома прошла через несколько ключевых этапов, каждый из которых вносил важные уточнения в понимание структуры материи.
«Пудинг с изюмом»
Дж. Дж. Томсон предложил модель, согласно которой атом представляет собой положительно заряженную сферу с вкрапленными в нее электронами.
- Впервые введено понятие электрона как составной части атома
- Атом больше не считался неделимым
Модель Резерфорда
Эрнест Резерфорд предложил планетарную модель атома на основе экспериментов по рассеянию альфа-частиц.
- Атом состоит из плотного положительно заряженного ядра
- Электроны движутся вокруг ядра по орбитам
- Большая часть объема атома - пустое пространство
Недостаток: Согласно классической электродинамике, электрон, движущийся по орбите, должен излучать энергию и в конечном итоге упасть на ядро.
Модель Бора
Нильс Бор ввёл допущение, что электроны в атоме могут двигаться только по определённым стационарным орбитам.
- Электроны не излучают энергию на стационарных орбитах
- Излучение происходит только при переходе между орбитами
- Объяснены спектральные линии атома водорода
Модель Зоммерфельда
Арнольд Зоммерфельд внёс уточнение, что электронные орбиты могут иметь не только форму окружности, но и эллипса.
- Введено понятие азимутального квантового числа
- Учтена релятивистская зависимость массы от скорости
- Объяснена тонкая структура спектральных линий
Волновая модель
Эрвин Шрёдингер разработал волновое уравнение, описывающее поведение электронов в атоме.
- Электроны описываются как волновые функции
- Введено понятие электронного облака
- Орбиты заменены на орбитали - области вероятного нахождения электрона

Строение атома
Таким образом, в центре атома находится положительно заряженное ядро, вокруг которого по определенным круговым и эллиптическим орбитам (они называются стационарными) вращаются электроны. Ядро находится в одном из фокусов эллиптической орбиты или в центре круговой орбиты. Основная масса атома сосредоточена в ядре.
В соответствии с первым постулатом Бора каждой стационарной орбите соответствует определенное значение энергии. Т.е., если описывать энергетический спектр атома, то каждая из этих орбит может быть охарактеризована энергетическим уровнем.
В соответствии с моделью многоэлектронного атома в его центре находится положительно заряженное ядро, окружённое электронами, которые распределяются по оболочкам, т.е. находятся на энергетических уровнях атома. Количество электронов на каждой оболочке ограничено, как это показано на рисунке 5.
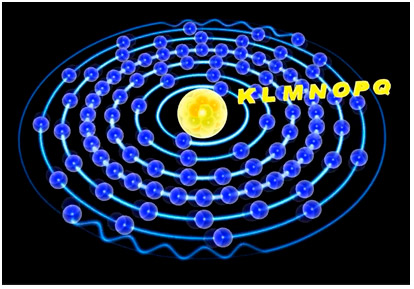
Рисунок 5 - Расположение электронов на оболочках атома
Чем дальше от ядра находится вращающийся электрон, тем выше его энергетический уровень. Электроны, находящиеся на последней оболочке атома, обладают наибольшей энергией, слабее связаны с ядром, легче вступают во взаимодействие с другими атомами и называются валентными.
Энергетические уровни атома определяются квантовыми числами. Главное квантовое число \(n\) определяет в основном дискретные энергетические уровни (рисунок 6).
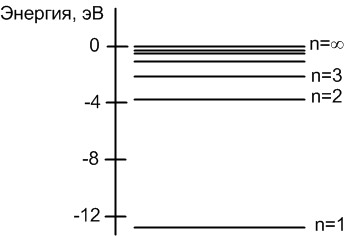
Рисунок 6 - Что такое главное квантовое число?
Орбитальное квантовое число \(l\) определяет орбитальный момент импульса электрона, т.е. указывает на форму орбитали по которой движется электрон. Магнитное квантовое число \(m\) определяет проекцию орбитального момента на выделенное направление, т.е. характеризует пространственную ориентацию атомной орбитали. Спиновое квантовое число \(s\) определяет собственный момент импульса электрона — магнитный момент, возникающий при вращении заряда электрона вокруг собственной оси.
При этом, в соответствии с принципом Паули, электроны, входящие в состав одного и того же атома, отличаются хотя бы одним квантовым числом.
В соответствии со вторым постулатом Бора, при переходе электрона с одного разрешенного уровня на другой, более отдаленный, происходит поглощение энергии, а при обратном переходе — выделение энергии. Поглощение и выделение энергии может происходить только строго определенными «порциями» — квантами. Расстояние между энергетическими уровнями уменьшается по мере увеличения энергии. «Потолком» энергетического спектра является уровень ионизации, на котором электрон приобретает энергию, позволяющую ему стать свободным электроном и покинуть атом.
Агрегатные состояния вещества
Атомы и молекулы, объединяясь между собой в силу действия того или иного вида связи, образуют вещества, которые могут находиться в одном из трёх агрегатных состояний: твёрдом, жидком и газообразном. Часто выделяют ещё и четвёртое состояние вещества — плазму (рисунок 7).

Рисунок 7 - Агрегатные состояния вещества
Различие этих состояний проявляется, главным образом, в разной упорядоченности частиц, образующих данное вещество. Коротко вспомним основные особенности и свойства, характерные для каждого агрегатного состояния.
Газообразное состояние
Поскольку звезды, облака межзвёздного вещества, атмосферы планет и другие космические объекты состоят из газов (рисунок 8), то можно с уверенностью утверждать, что газообразное состояние вещества является самым распространённым состоянием вещества во Вселенной.

Рисунок 8 - Газы во Вселенной
На Земле газы образуют атмосферу планеты, содержатся в твёрдых земных породах, океанах, морях и других водоёмах (рисунок 9). Они редко встречаются в чистом виде, как правило — это смеси газов.

Рисунок 9 - Примеры газов на Земле
Характерной особенностью строения газов является достаточно большое, по сравнению с другими агрегатными состояниями вещества, расстояние между молекулами. По этой причине молекулы газов практически не взаимодействуют друг с другом и силы взаимодействия между ними настолько малы, что ими пренебрегают. Молекулы газов совершают беспорядочное тепловое движение, поэтому находятся в неупорядоченном состоянии, и, при отсутствии внешних воздействий, расширяются до объема в котором они находятся.
Частицы газа электрически нейтральны, т.е. не проводят электрический ток. Хорошим примером плохой электропроводности газов является воздух, который нас окружает и защищает от поражения электрическим током. Однако, если газ подвергнуть ионизации, то он начинает обладать некоторой электропроводностью.
Ионизация
В самом простом понимании, ионизация — это процесс образования ионов. Ион — это электрически заряженная частица (например, атом), образующаяся в результате потери (положительный ион) или присоединения (отрицательный ион) атомом или молекулой одного или нескольких электронов. Отсюда, ионизированный газ означает, что это газ, от электронных оболочек значительной части атомов или молекул которого отделён по крайней мере один электрон (или, наоборот, присоединён по крайней мере один электрон). Ионизация не является процессом, характерным только для газов, ионы встречаются во всех агрегатных состояниях вещества.
В 1834 году Майкл Фарадей открыл ион и установил, что под действием электрического тока положительно заряженные ионы (катионы) движутся к отрицательному полюсу — катоду, а отрицательно заряженные ионы (анионы), движутся к положительному полюсу — аноду.
Плазма
Частным случаем газообразного состояния вещества является, так называемое, четвёртое агрегатное состояния вещества — плазма. Плазма — это полностью или частично ионизированный газ, который может оставаться электрически нейтральным (квазинейтральным) даже при наличии свободных носителей заряда или быть не квазинейтральным. Присутствие свободных электрических зарядов делает плазму проводящей средой.
Жидкое состояние
Характерной особенностью строения жидкостей является некоторая упорядоченность расположения молекул и гораздо меньшие расстояния между ними по сравнению с газами. Жидкости, как и газы, не имеют постоянной формы, но в отличии от них характеризуются определённым объёмом. По своей природе жидкое агрегатное состояние вещества является переходным от неупорядоченного газообразного к упорядоченному твёрдому агрегатному состоянию вещества.
Твёрдое состояние
Твёрдое агрегатное состояние вещества, в отличие от жидкого и газообразного, характеризуется стабильностью формы и способностью сохранять её под воздействием силы тяжести. Твёрдые тела могут быть аморфными или кристаллическими.
Кристаллические решётки
В кристаллических телах атомы, молекулы или ионы располагаются в строго определённых положениях — узлах. При мысленном соединении этих узлов пересекающимися прямыми линиями образуется пространственный каркас, который называют кристаллической решёткой (рисунок 10).
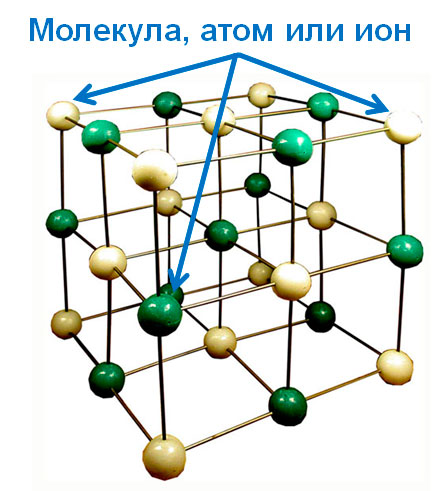
Рисунок 10 - Пример кристаллической решётки
Узлы кристаллической решётки совершают тепловые колебательные движения относительно положения покоя. С повышением температуры амплитуда колебаний возрастает, что проявляется в тепловом расширении твёрдых тел и изменении их электропроводности. В зависимости от вида частиц и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические.
Ионные кристаллические решётки
Кристаллические решётки, состоящие из ионов, называются ионными (рисунок 11). Их образуют вещества с ионной связью. Примером может служит кристалл хлорида натрия, в котором каждый ион натрия окружен шестью хлорид-ионами, а каждый хлорид-ион - шестью ионами натрия. Связи между ионами в кристалле очень прочные и устойчивые. Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
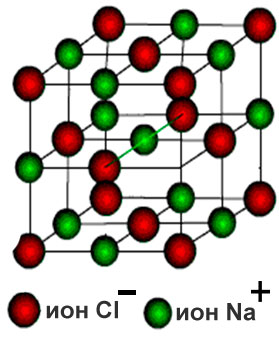
Рисунок 11 - Ионная кристаллическая решётка кристалла хлорида натрия
Атомные кристаллические решётки
Кристаллические решетки, в узлах которых находятся отдельные атомы, называются атомными (рисунок 12). Атомы в них соединены прочными ковалентными связями, поэтому вещества с атомной кристаллической решёткой имеют высокие температуры плавления и обладают повышенной твёрдостью. Например, алмаз, в кристаллической решётке которого отсутствуют молекулы является самым твёрдым материалом в природе.
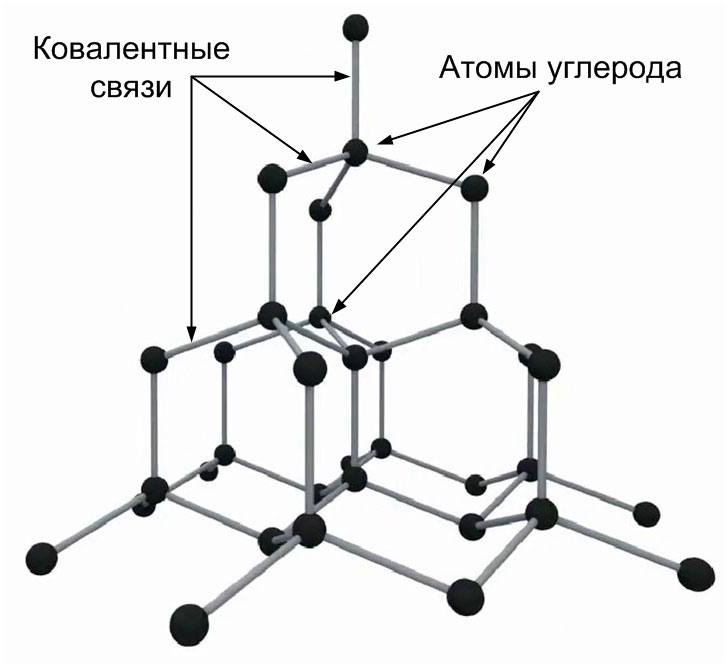
Рисунок 12 - Атомная кристаллическая решетка алмаза
Молекулярные кристаллические решётки
Кристаллические решетки, состоящие из молекул, называются молекулярными. Молекулы в них соединены сравнительно слабыми межмолекулярными силами и вещества с молекулярными решётками обладают малой твёрдостью, низкими температурами плавления, нерастворимы или малорастворимы в воде. Вещества с молекулярной кристаллической решёткой почти не проводят электрический ток.
Например, твердые простые вещества, образованные одно- (благородные газы), двух- (\(F_2\), \(Cl_2\), \(Br_2\), \(I_2\), \(H_2\), \(O_2\), \(N_2\)), трех- (\(O_3\)), четырех- (\(P_4\)), восьми- (\(S_8\)) атомными молекулами. Молекулярная кристаллическая решетка йода показана на рисунке 13.
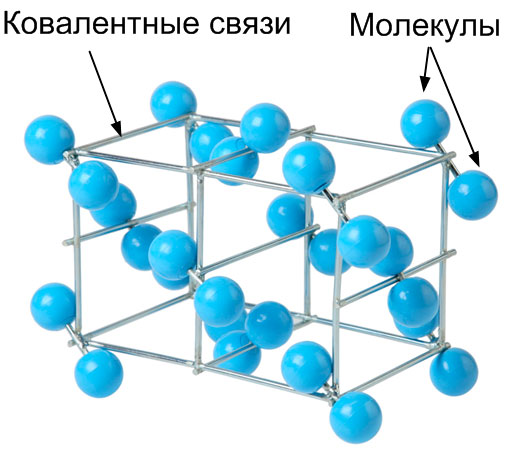
Рисунок 13 - Молекулярная кристаллическая решетка йода
Металлические кристаллические решётки
Металлическими называют решётки, в узлах которых находятся атомы и ионы металла (рисунок 14). Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность.
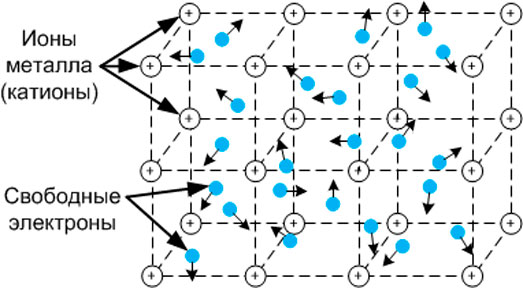
Рисунок 14 - Металлическая кристаллическая решетка металлов
Все кристаллические структуры описываются 14 решётками Браве (рисунок 15).
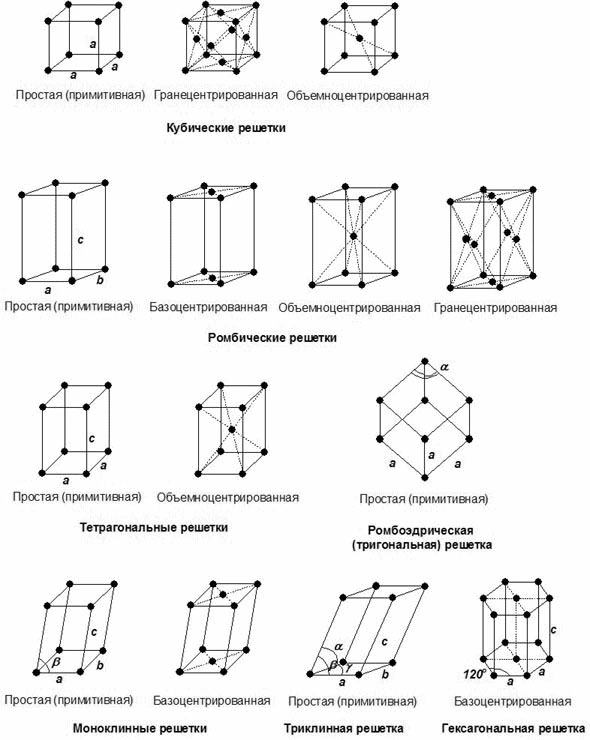
Рисунок 15 - Решётки Браве
Физические свойства кристаллических тел неодинаковы в различных направлениях, но совпадают в параллельных направлениях. Это свойство кристаллов называют анизотропностью. Кристаллическое строение имеют металлы и их сплавы, а также ряд других материалов (слюда, мрамор и др.).
Аморфные тела
Материалы, в которых физические свойства в различных направлениях одинаковы, называются аморфными или изотропными (рисунок 16).
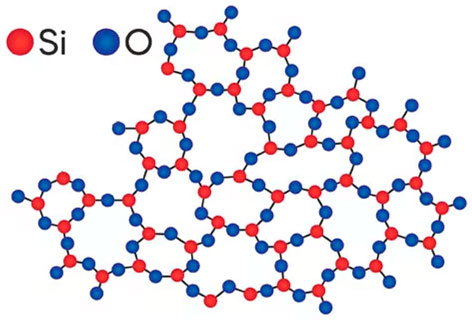
Рисунок 16 - Строение аморфного тела. Кварцевое стекло
Аморфное тело не обладает дальним порядком в расположении атомов и молекул. При внешних воздействиях аморфные тела обнаруживают одновременно упругие свойства, характерные твердым телам, и текучесть, характерную для жидкостей. Аморфные тела не имеют четко выраженную температуру плавления и переходят из твердого состояния в жидкое путем постепенного размягчения.
Аморфную структуру имеют изделия из стекла и большинство органических материалов, например: куски затвердевшей смолы и янтарь (рисунок 17).

Рисунок 17 - Примеры аморфных тел
Некоторые твердые тела имеют смешанное строение, т.е. наряду с кристаллическим строением в них встречаются участки с аморфным строением, например, керамика, состоящая из стекловидной аморфной и кристаллической массы.
Посмотрите учебный видеоролик

